21 Ноя Микробиологические методы исследования замороженных пищевых продуктов
При соответствующем состоянии качества исходного сырья, а также правильном ведении процесса переработки и замораживания опасность микробиальной порчи практически отсутствует.
Случаев пищевых отравлений микроорганизмами, развивающимися в замороженных продуктах, за исключением мороженого, не бывает. Вместе с тем применение бактериологических стандартов при оценке качества замороженных пищевых продуктов является спорным. Отказ от них объясняют бактериостатическим воздействием низких температур при замораживании и хранении в замороженном виде. Наряду с этим целесообразность применения бактерии логических стандартов объясняют, в частности, отсутствием стерильной среды, неполной гибелью микроорганизмов при замораживании, возможностью воздействия их ферментов и токсинов, наличием условий для возникновения повторных заражений.
В связи с вышеизложенным отсутствуют общепринятые бактериологические стандарты и однородные методы микробиологических исследований пищевых продуктов. Предъявляемые в различных странах требования относятся только к некоторым ассортиментным группам замороженных продуктов и, как правило, определяют допустимый уровень общей обсемененности и титр Соli или же предельное количество других показательны микроорганизмов.
Существуют многочисленные предложения о введении бактериологических критериев оценки качества замороженных продуктов. На основании исследований ВНИХИ сформулированы предложения о допустимых нормах бактериальной обсемененности замороженных плодов, овощей и блюд, готовых к употреблению (табл. 1). Ученый Арпай предложил близкие предельные нормы количества микроорганизмов (в 1 г продукта) в замороженных плодах в пределах от 100 тыс. (для смородины до 500 тыс. (для клубники); в замороженных овощах от 100 тыс. (для огуречного салата) до 1 млн. (для шпината). Титр Coli должен составлять соответственно для большинства плодов – более 0.1 (в исключительных случаях более 0.01), а для овощей – более 0.01.
Санитарные, нормы, применяемые во Франции, допускают следующую бактериальную обсемененность: для замороженных плодов и овощей общая обсемененность 1 – 5·105 и титр Coli более 0.01; для замороженных продуктов животного происхождения – 5·105 – 5·107 и титр Coli 0.01–0.001; для замороженных блюд, готовых к потреблению, 1 – 3·105 и титр Coli более 0.1 (в исключительных случаях более 0.01).
Изучение литературных данных показывает, что разные авторы применяют различные методы микробиологического анализа замороженных пищевых продуктов, что часто делает невозможным сравнение и однозначную интерпретацию полученных результатов. Расхождения в методике исследований относятся не только к величине образцов и способу их получения, но и к способам измельчения, химическому составу жидкостей, применяемых для разбавления исходного материала, и реакции среды питательных сред, а также к методам посевов материала и температуре инкубации.
Таблица 1 – Допустимая бактериальная обсемененность плодов, овощей и блюд, готовых к употреблению
| Качество | Плоды | Овощи | Блюда, готовые к употреблению | Плоды | Овощи | Блюда, готовые к употреблению |
| Общее количество микроорганизмов | Титр Coli | |||||
| Хорошее | <100000 | <250000 | >1 | >0.1 | ||
| Удовлетворительное | <250000 | <500000 | <50000 | >0.1 | >0.01 | >0.1 |
| Неудовлетворительное | >250000 | >500000 | >50000 | <0.1 | <0.01 | <0.1 |
В последнее время опровергается пригодность широко используемых методов бактериологических исследований для контроля продуктов, в частности классического метода определения общего количества микроорганизмов посредством посевов на питательных средах. Причины этого – большая продолжительность термостатирования, а также рост количества обнаруживаемых колоний – связаны с увеличением степени разбавления проб, что обусловлено прогрессирующим делением колоний микроорганизмов.
На протяжении продолжительного времени предпринимаются попытки определения бактериальной обсемененности значительно более простыми и быстрыми реакциями на редуктазу, основанными на изменениях окраски соответствующим образом подобранных, индикаторных реактивов. Чаще всего используют метиленовую синь, восстанавливающуюся до бесцветной формы, тетразоловые соединения, в частности 2, 3, 5-трифенилтетразол, тетразоловый пурпур, тетразоловую синь, а также резазурин. По мере увеличения общего количества аэробных микроорганизмов на поверхности исследуемых продуктов сокращается продолжительность восстановления индикаторных реактивов, причем достигается высокий уровень отрицательной корреляции между реакциями восстановления. Исследования А. О. Авакяна показали, что при уровне обсеменеиности продуктов порядка 105 бактерии в 1 г реакция с трифенилтетразолом происходит через 13 – 15 ч выдержки в термостате при температуре 37 °С; при обсеменеиности от 106 до 108 в 1 г изменение окраски происходит в течение 5 – 8 ч, а при обсемененности выше 108 – в течение менее 1 ч.
Пригодность для контроля реакции с трифенилтетразолом и резазурином подтверждена сравнительными исследованиями Центральной холодильной лаборатории в Лодзи (Польша). На рис. 1 представлена зависимость между продолжительностью восстановления резазурина и логарифмом количества микроорганизмов в пересчете на 1 см2 поверхности тушек птицы, полученная на основании исследований Центральной лаборатории птицеперерабатывающей промышленности в г. Познань (Польша). Продолжительность восстановления ниже 2 ч свидетельствует о высокой бактериальной обсемененности тушек птицы.
Фергусон исследовал возможность применения реакции с резазурином для микробиологического контроля замороженных овощей и установил, что скорость реакции обусловлена рядом факторов, в частности, жизнеспособностью микрофлоры продуктов, параметрами бланширования, а также содержанием природных редуцирующих веществ, например аскорбиновой кислоты. В целом степень восстановления резазурина не является пропорциональной содержанию мезофильной аэробной микрофлоры. В бланшированных образцах по сравнению с небланшированными при одинаковой бактериальной обсемененности наблюдалось более быстрое изменение окрашивания. Это указывает на образование во время тепловой обработки редуцирующих веществ, причем параметры процесса влияют на уровень восстановления резазурина.
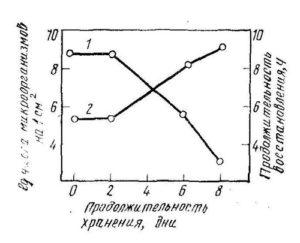
Рисунок 1 – Зависимость продолжительности восстановления резазурина и степени обсемененности тушек птицы от продолжительности хранения
1 – продолжительность восстановления резазурина; 2 – степень обсемененности тушек птицы
Ведутся также исследования с целью установления пригодности для контроля экспрессных микробиологических тестов, в частности, З-СА (на бактерии Coli), З-ПРМ (на общее количество редуцирующих микроорганизмов) и З-П (на плесневые грибы). Однако эти тесты в зависимости от вида микроорганизмов в 10 – 1000 раз менее чувствительны, чем стандартные.
Д. М. Джей предложил быстрый метод определения бактериальной обсемененности замороженных продуктов животного происхождения, так называемый тест ЕРВ (объемное выделение экстракта), основанный на определении объема фильтрата, выделяемого из образца мяса в течение определенного времени после добавления стандартного количества буферного раствора. Из мяса с высокой бактериальной обсемененностью получают вязкие гомогенные смеси, из которых в процессе фильтрации выделяется жидкости меньше, чем из свежего мяса. Установлен высокий уровень отрицательной корреляции между результатами определения по этому методу и общей бактериальной обсемененностью мяса; по данным Д. М. Джея, он составляет – 0.89 – 0.914. Исследования показали, что на результат определений с использованием теста ЕРВ влияют вид микрофлоры, pН и условия хранения мяса. Более высокие результаты определений получают при увеличении содержания белков в продукте.
